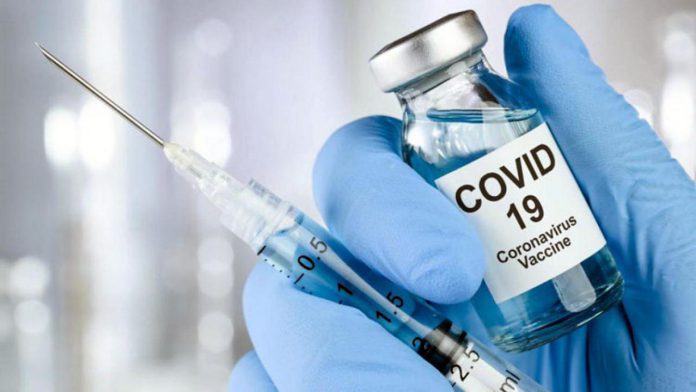
Osakidetzaren Biodonostia eta Biocruces Bizkaia Ikerketa Sanitarioko Institutuak aukeratu dituzte Alemaniako Curevac enpresa farmazeutikoak garatu eta sustatu duen SARS-CoV-2aren aurkako txertoaren eraginkortasuna eta segurtasuna egiaztatuko duen saiakuntza klinikoan parte hartzeko. Euskal Autonomia Erkidegoak, beraz, estatuan aukeratu dituzten hiru zentroetako bi eskainiko ditu (hirugarrena, Madrilgo Erkidegoarena da). Garrantzi handiko saiakuntza klinikoa da. Mundu osoan 30.000 lagun baino gehiagok hartuko dute parte; horietako 2.000 inguru Euskal Autonomia Erkidegoak ipini ditzake.
Curevac Alemaniako enpresa biofarmazeutiko bat da. Enpresa horrek immunitate-sistema estimulatzen duen RNA mezulariaren mekanismoan —gaur egun banatzen ari diren Pfizer-en eta Moderna-ren bi txertoek erabiltzen duten bera— oinarritutako txerto bat garatu du. Hala ere, Curevacen txertoak jada merkaturatutako txertoak erabiltzeko topatzen dituzten oztopoetako bat gainditzen du; izan ere, Curevacen txertoa mantentzeko eta prestatzeko baldintzek bere banaketarako logistika errazten dute. Gainera, Europan produzitzen denez, gure esparruko herrialdeetan dosi gehien banatzeko konpromisoa hartu duen txertoetako bat da.
Euskal Autonomia Erkidegoak nazioarteko saiakuntza kliniko honetan parte hartzeak osasun-sistemaren —osasun-sistema asistentziala zein ikerketakoa— ahalmena eta Eusko Jaurlaritzaren Osasun Sailak esparru biosanitarioan egindako apustua erakusten du. Eta hori guztia aurrera eraman ahal izan da Osakidetzako Zerbitzu Erakundean, BIOEFan eta Ikerketa Sanitarioko Institutuan diharduten pertsonen lanari esker. Institutu horiek saiakuntza klinikoen esparruan duten esperientzia funtsezkoa izan da euren aukeraketan.
Azterketa hori, gainera, pandemia hau hasi zenetik Euskal Osasun Sistema garatzen ari den ikerketa-jarduerari gehitu zaio, eta COVID-19ari aurre egiteko —beharrezkoa maila globalean krisia kontrolatzeko— txerto berri bat garatzen laguntzeko aukera bikaina da.
Parte-hartzea
18 urtetik gorako eta azterketaren protokoloan adierazitako irizpideak betetzen dituzten Euskal Autonomia Erkidegoko pertsona guztiek saiakera horretan parte hartu ahal izango dute hala nahi badute. Saiakuntza kliniko honetan parte hartuko duten boluntarioak modu aleatorioan banatuko dituzte, batzuk, txertoa jasoko duten taldean eta, besteak, plazeboa —hau da, inolako ondoriorik ez duen konposatu bat (gatz-serum)— jasoko duten taldean. Ez pazienteak, ez datuak biltzeaz eta jarraipena egiteaz arduratzen diren profesionalek ez dute jakingo subjektu bakoitza zein taldetan dagoen. Horrela, azterketaren bidez bildutako datuen kalitatea eta zorroztasuna bermatzen da. Entsegu honetan txertoaren bi dosi jarriko dira 28 eguneko tartearekin. Parte-hartzaileei urtebetez luza daitekeen jarraipena egingo diete, bisita medikoen eta telefono deien bidez. Gainera, informazioaren erregistroa erraztuko duen mugikorrerako aplikazio batean sartu ahal izango dira. Parte-hartzaileek, nahi dutenean, azterketatik irtetea eskatu ahal izango dute. Halaber, txertoa edo plazeboa jaso zuten ere jakin ahal izango dute. Hiru eta sei hilabeteko epean bitarteko analisiak egingo dituzte. Emaitzen arabera, txertoaren erabilera onartzeko prozesua azkartu daiteke, jada merkatuan dauden txerto batzuen kasuan gertatu den bezala.
Datozen egunetan, beharrezko dokumentazio eta errekerimendu guztiak prest daudenean, Biodonostia eta Biocruces Bizkaia Institutuek parte-hartzaileak biltzeko prozesuak jarriko dituzte martxan. Prozesu horien berri bere garaian emango da.
Vitoria-Gasteiz, 2021eko urtarrilaren 20a